열역학 - Ideal soultion에서 혼합 엔트로피와 깁스 자유에너지 변화 entropy and Gibbs free energy of mixing

지난 번 포스팅에 이어서 오늘 포스팅에서는
Ideal solution에서 혼합 엔트로피와 깁스자유에너지 변화를 계산해보겠다.
이 내용은 여러 물질이 섞여 있을 때의 변화를 살펴보는 것이라,
열역학 뿐만 아니라 화학 반응 등 굉장히 중요하게 사용되는 식이라 볼 수 있다.
지난 번 포스팅에서는 여러 물질이 혼합되어있을 때, Partial Property, Gibbs-Duhem equation 등을 살펴보았는데,
계속해서 상평형 그림 등을 다룰 예정이라서,
그 순서에 맞게 업로드를 하고 있는 것이라 보면 되겠다.
저번 포스팅이 궁금하다면 아래를 참고하자.
[열역학] 부분성질과 화학퍼텐셜, 깁스-듀헴 방정식 (Partial property, Chemical potential, Gibbs-Duhem equation
열역학 - 부분성질, Partial property 오늘 포스팅부터는열역학을 공부하면서 중요한 것들을 뽑아 깔끔하게 정리해서 기록해볼까 한다. 아무래도 전공과목이다 보니, 개념에 대한 자세하고 친절
gyuuuul.tistory.com
지난 번에도 언급했듯, 전공 내용을 포스팅하다 보니, 기본적인 개념에 대한 설명은 생략하고 있음을 양해 부탁한다.
그럼 시작해보자!
1. 엔트로피와 깁스 자유에너지
엔트로피와 깁스 자유에너지에 대해 할 이야기는 많지만, 생략하도록 하고.
두 개념을 모두 이해하고 있다는 가정하에 본 포스팅을 적어본다.
통계역학적으로 엔트로피(S)와 깁스 자유에너지 정의는 다음과 같이 주어이다.
$$ S =k_B ln \omega $$
$$ G = H- TS $$
2. Ideal solution에서 혼합 깁스 자유에너지 계산하기
Gibbs free energy of mixing을 계산해보자.
계산을 쉽게하기 위해, binary solution 상황을 생각해보자.
또한 Ideal solution에서만의 경우를 다룰 것이다.
$$ \Delta G_{\text{mix}} = \Delta H_{\text{mix}} - T \Delta S_{\text{mix}} $$
$$ \Delta G_{\text{mix}} = -T \Delta S_{\text{mix}} $$
2.1 entropy of mixing 계산 및 정리
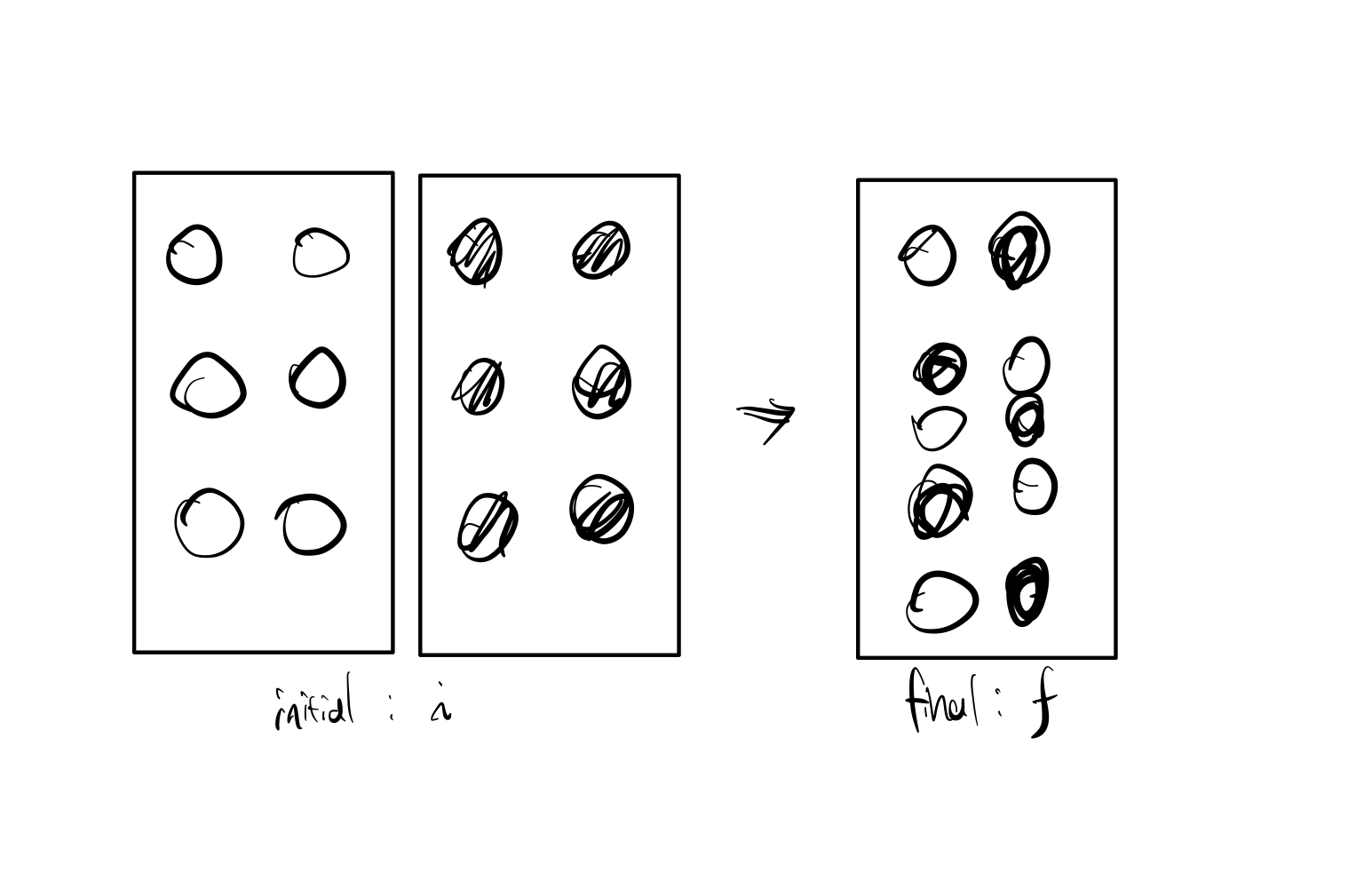
혼합 전 엔트로피를 구해보자.
혼합 전에는 그림 왼쪽에서 보듯, 원자들이 배열할 수 있는 경우의 수가 1가지 이므로 $ \omega = 1 $ 이므로,
혼합 전 엔트로피는 $ S_i = 0 $ 이 된다.
$$ \begin{align} S_f &= k_B \ln \omega \\ &= k_B \ln \frac{(N_A + N_B)!}{N_A!N_B!} \\ &= k_B \ln \frac{N_T!}{N_A!N_B!}\\ &\approx k_B \left( N_T \ln N_T - N_A \ln N_A - N_B \ln N_B \right) \end{align} $$
위 근사는 스털링 근사(Stirling's Approximation) $ \ln N! \approx N \ln N - N $ 를 사용한 것이다.
계속해서 식을 정리하면,
$$ \begin{align} S_f &= -k \left( -N_A \ln N_T - N_B \ln N_T + N_A \ln N_A + N_B \ln N_B \right) \\ &= -k \left( N_A \ln X_A + N_B \ln X_B \right) \\ &= -k N_T \left( X_A \ln X_A + X_B \ln X_B \right) \\ &= -R \left( X_A \ln X_A + X_B \ln X_B \right) \end{align} $$
따라서 mixing of entropy 는 다음과 같다.
$$ \therefore \Delta S_{\text{mix}} = -R \left( X_A \ln X_A + X_B \ln X_B \right) $$
2.2 Gibbs free energy of mixing구하기
위에서 정리한 깁스 자유에너지 식에 $ \Delta S_{\text{mix}} $ 를 대입하면,
G of mixing 를 구할 수 있다.
$$ \Delta G_{\text{mix}} = RT \left( X_A \ln X_A + X_B \ln X_B \right) $$
처음 식에 대입하면, 다음을 얻는다.
$$ G_f = X_A G_A + X_B G_B + RT \left( X_A \ln X_A + X_B \ln X_B \right) $$
2.3 그래프 해석하기
위에서 작성한 S, G of mixing을 그래프를 통해 알아보자.
이 그래프를 해석하는 것이 정말 중요하거니와, 수식으로만 이해하면 감이 오지도 않을 것 같아 그렇다.
먼저, mixing을 하기 전, 순수한 A와 B의 자유에너지 합을 표현할 수 있다.
즉, $ G_i $ 를 그래프에 나타내보자.

이번엔, G of mixing을 그래프에 표현해보자.
다시한 번 remind 하자면, 아래 식을 그래프에 그리면 되겠다.
$$ \Delta G_{\text{mix}} = RT \left( X_A \ln X_A + X_B \ln X_B \right) $$
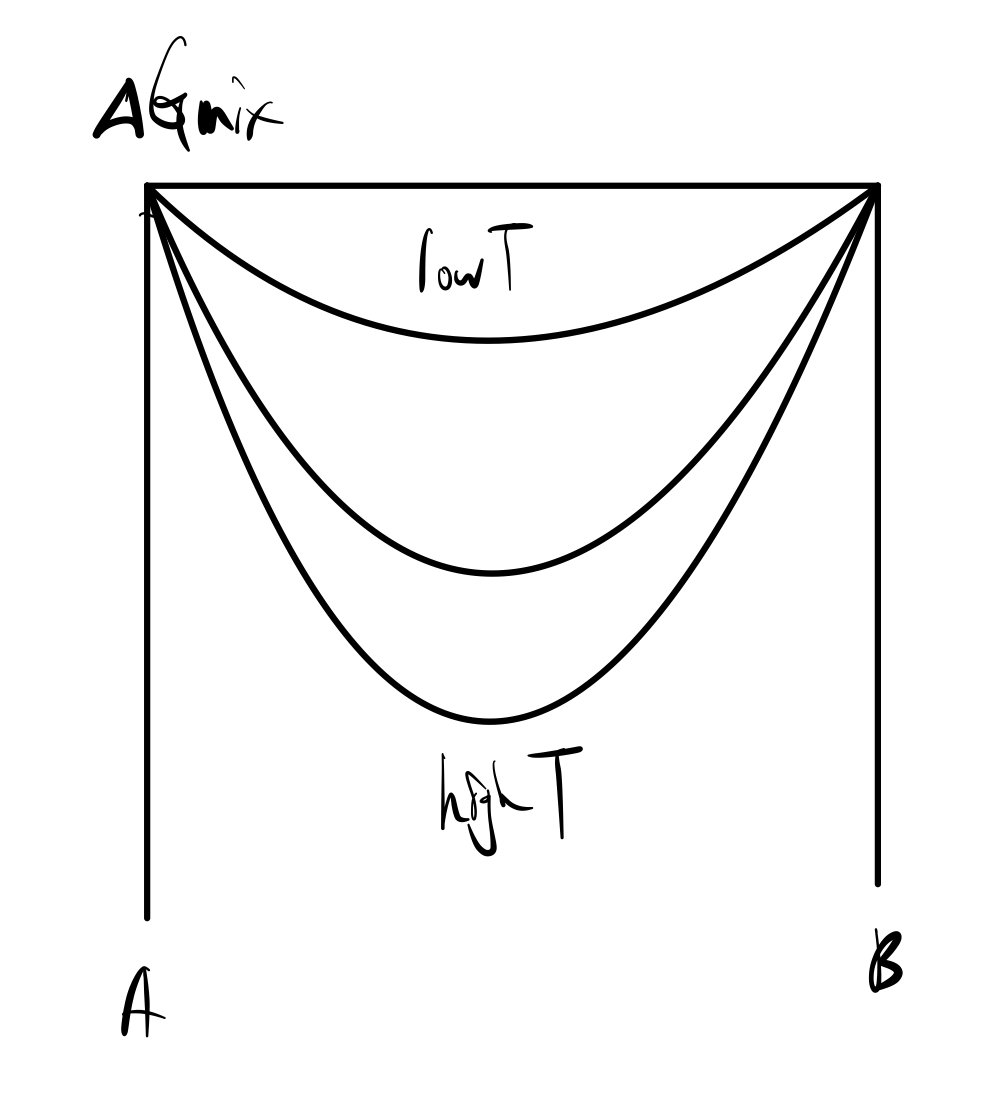
식에서 보듯, T와 G of mixing은 비례하므로 그래프에서도 T가 커질수록 G of mixing이 아래로 더 내려감을 볼 수 있다.
마지막으로, 위 두 그래프를 더하면, mixing이 일어난 후의 G를 구할 수 있었다.
즉, $ G_f $ 를 그려보자는 것이다. 위에서 유도했 듯, 아래 식을 그래프에 그려주면 되겠다.
$$ G_f = X_A G_A + X_B G_B + RT \left( X_A \ln X_A + X_B \ln X_B \right) $$
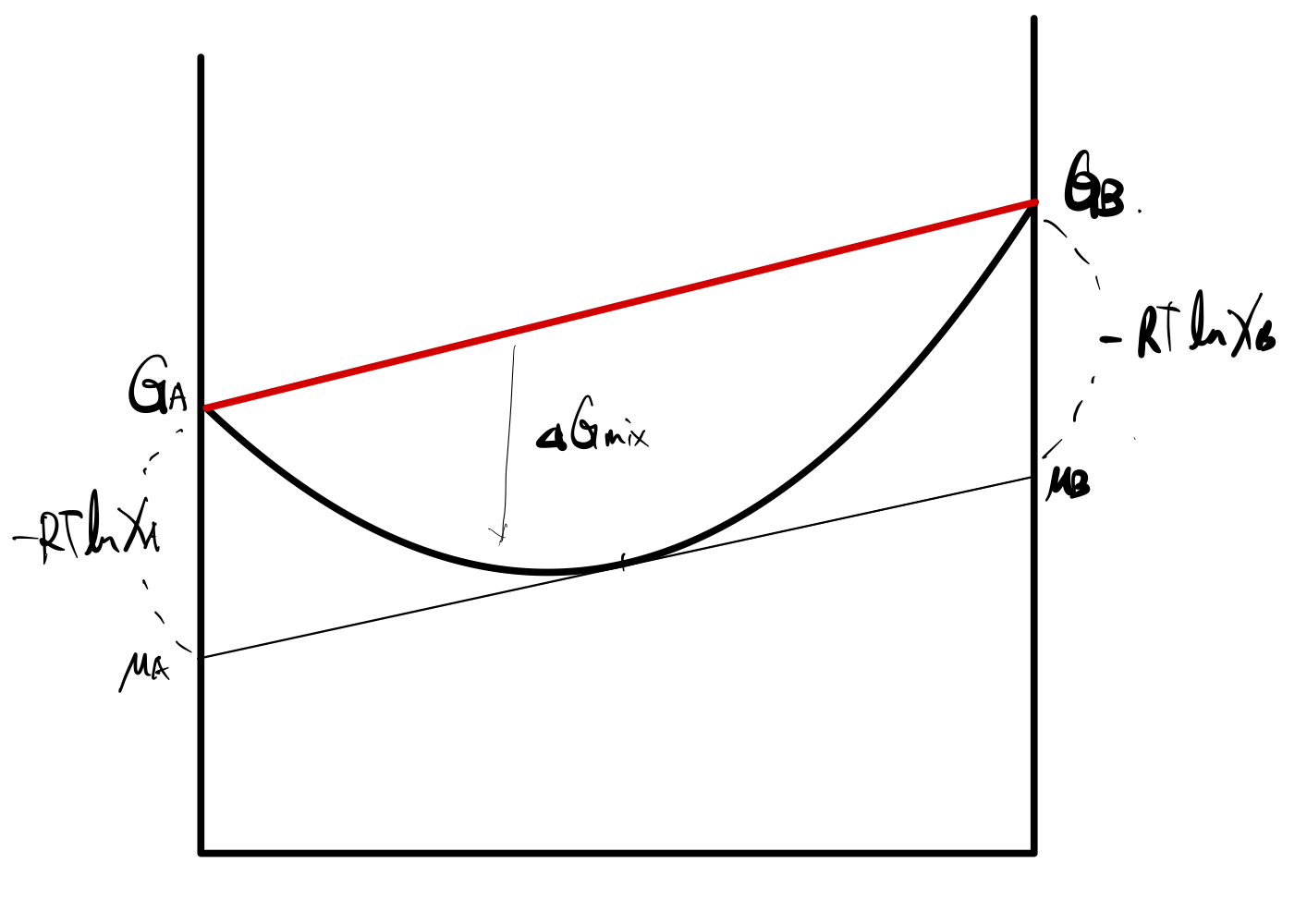
정말 중요한 그래프가 되겠는데, 특히 G그래프에 접선을 그렸을 때,
그 교점이 각 성분의 화학 퍼텐셜(chemical potential)이 됨을 우리는 이미 알고 있다.
(지난 포스팅의 partial property를 참고하자.)
뿐만아니라 각각의 성분에서 $ G $ 와 $ \mu $ 값의 차이를 꼭 이해하자.
G of mixing 식을 생각해보면 너무나도 당연하다.
저 식은 정말 중요한 식이 아닐 수 없다.
오늘 포스팅은 여기서 마친다.
궁금한 것이나 질문사항이 있다면 언제든 댓글을 남겨주면,
시간이 되는대로 친절히 답변을 해보도록 노력해보겠다.
그럼 안녕~~!!




