
지난 포스팅에 이어서, 열역학 기본 개념들과 법칙에 대해서 설명해보도록 하겠다.
오늘은 내부에너지와 일, 그리고 열에 대한 개념, 그리고 열역학에서 가장 중요하다고 이야기할 수 있는 열역학 제 1법칙에 대해서 다뤄보도록 하겠다.
이전 포스팅이 궁금하다면 여기를 참고하도록 하자.
2025.03.16 - [전공 공부정리/열역학] - [열역학] 1.1 기본개념들 - 계와 주위, 상태와 상태량, 경로와 과정, 상태함수와 경로함수
[열역학] 1.1 기본개념들 - 계와 주위, 상태와 상태량, 경로와 과정, 상태함수와 경로함수
지금까지 열역학 포스팅을 몇 개 올려두었는데, 가장 기본이 되는 용어나 열역학 법칙들에 대한 포스팅이 없었던 것 같다. (지금까지는 binary solution에 대해서만 다루었다. 이전의 포스팅이 궁금
gyuuuul.tistory.com
그럼 시작해보도록 하자~!!
1. 내부에너지(Internal Energy, U)
내부에너지란 열역학적 계(System) 내부의 전체 에너지를 포함하는 에너지를 말한다. 에너지의 개념을 잘 알고 있다면 당연하겠지만, 계의 전체 에너지는 운동에너지(Kinetic Energy)와 퍼텐셜에너지(Potential Energy - 위치에너지라고도 부른다)로 구성된다. 따라서, 내부에너지는 상태함수(State function)이자, 크기 성질(Extensive property)이다.
열역학에서 내부에너지는, 평형상태의 simple system에서 오직 두 개의 독립적인 variable로 구성될 수 있다. 자세한 내용은 깁스의 Phase Rule을 설명하면서 다루도록 하겠다.
$$ U = U(T, V) = U(T, P) = \cdots $$
2. 일(Work)과 열(Heat), 줄(Joule)의 일당량 실험
열역학에서 계(system)와 주위(surrounding) 사이에서는 일(Work)과 열(Heat)을 통해 상호작용할 수 있다. 일과 열에 대해서는 3번과 4번에서 살펴보도록 하고,
중요한 개념으로는 일과 열의 상관관계에 대해 다룬 줄의 일당량 실험이 있다. 아래 그림은, 오른쪽의 추를 떨어뜨려 연결된 터빈을 회전시키고, 그로 인해 발생한 마찰로 물의 온도를 상승시키는 기구를 나타낸 것인데, 이 과정에서 추의 위치에너지가 계 내부의 열에너지로 전환된다.
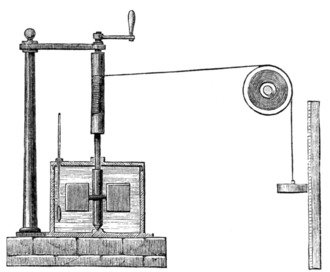
추를 계속해서 떨어뜨리게 되면, 더 많은 추의 위치에너지가 계 내부의 열로 전환될 것이므로, 열에 관한 식과 ( $ Q = C \Delta T $ ) 위치에너지 ($ Mgh $)가 같다고 놓으면, 다음을 얻는다.
$$ C \Delta T = Mgh $$
즉, 기계적인 일(work)이 열(heat)로 전환될 수 있으며, 둘은 모두 같은 형태의 물리량인 ‘에너지’임을 알 수 있다. 다시 말해, 일과 열은 본질적으로 같은 단위를 가짐을 뜻한다. 줄(Joule)은 이 실험을 정교하게 반복해서, 기계적 에너지 4.186 J가 물 1 g의 온도를 1°C 높이는 데 필요한 열량(1 cal)에 해당한다는 사실을 알아내었다. 이것이 줄의 일당량 실험이 되겠다.
그렇다면, 열역학에서 일과 열은 어떻게 정의할까? 차근차근 알아보자.
3. 일(Work)
3.1 물리학에서의 일
물리학을 잘 공부했다면 너무나 잘 알고 있겠지만, 일(Work, $ W $)은 다음과 같이 표현된다.
$$ dW = \vec{F} \cdot d \vec{X} $$
$$ W= \int \vec{F} \cdot d \vec{X} $$
여기서 $ \vec{F} $는 힘(Force), $ \vec {X} $는 변위(displacement)이다.
당연히 이것은 선적분(line integral)이므로, 다음이 자명하고,
$$ \oint dW \neq 0 $$
따라서 일은 경로의존적(path-dependent)이다.
3.2 열역학에서의 일
열역학에서의 일의 표현에 대해 알아보자.
먼저, 일의 부호를 정할 때는, 계(system)가 주위(surroundings)에 일을 할 때, 양수로 잡는다. (반대로 서술하는 경우도 있긴 하지만, 이게 일반적이다) 계가 주위에게 일을 받을 때는 음수가 되겠다.
따라서, 계(system)가 외력($ \vec{F_{ex}} $)에 대응해서 일을 하는 것을 다음과 같이 정의한다.
$$ dW = - \vec{F_{ex}} \cdot \vec {X} $$
$ W > 0 $ 이면, 계가 주위에 대해 일을 하는 것을 의미하고,
$ W < 0 $ 이면, 계가 주위에 의해 일을 받는 것을 의미한다.
앞에 - 부호가 붙은 것을 주의하도록 하자.
팽창/압축 과정에서의 일
아래 그림과 같이 피스톤 내부의 기체를 계(system)로, 피스톤의 윗 부분을 주위(surrounding)로 생각하자.
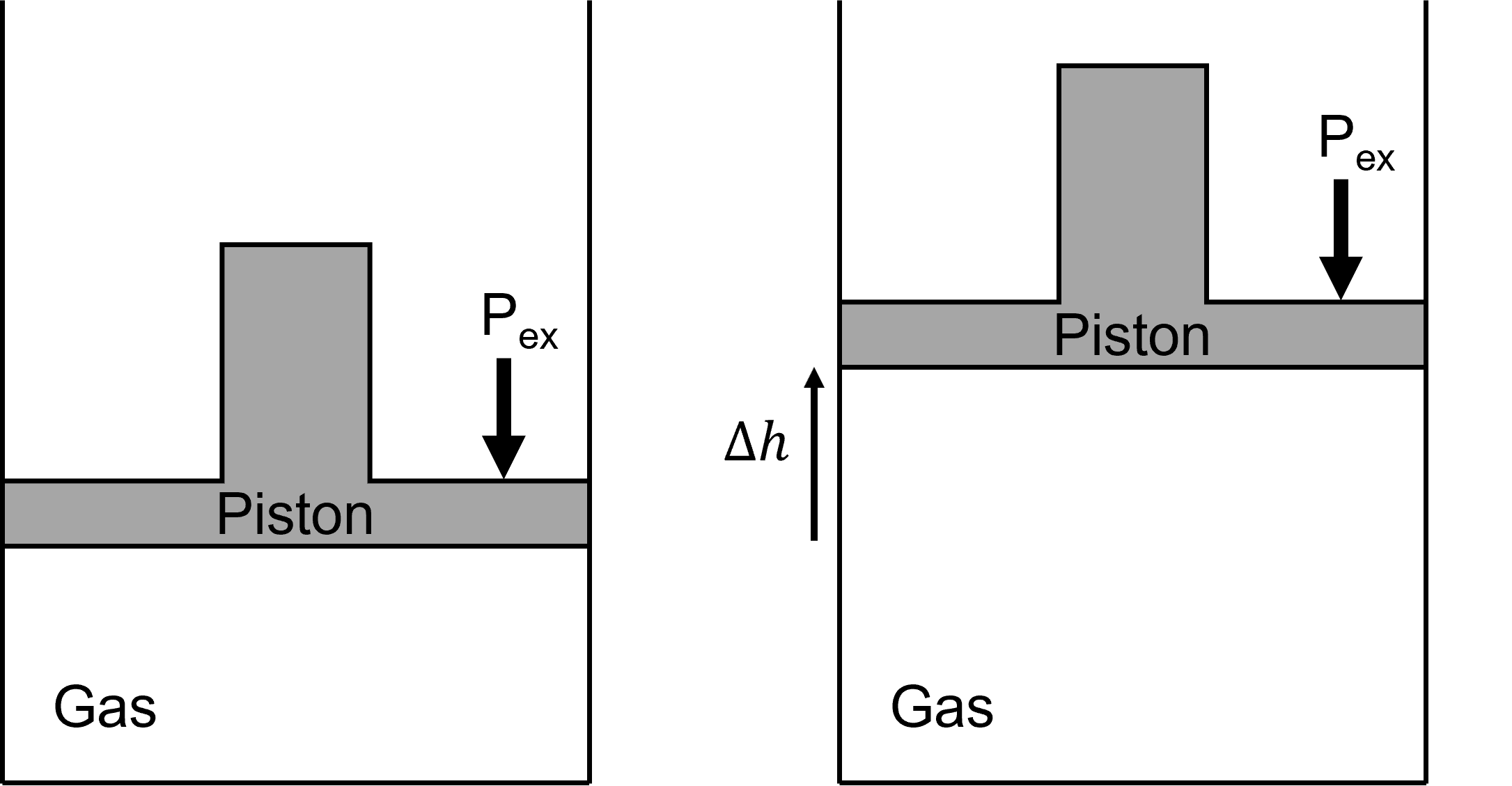
이때, 외력( $ P_{ext} $ ) 이 하는 일을 계산해보면 다음과 같다.
$$ \begin{align} w &= F \times \Delta h \\ &= \frac{F}{Area} \times Area \times \Delta h \\ & = P_{ext} \times \Delta V \end{align} $$
만약 이 과정이 가역과정(reversible)으로 진행된다면, 내부의 gas와 외부 압력이 같게 될 것이다.
$$ P_{gas} = P_{ext} $$
따라서, 열역학에서의 일은 다음과 같이 표현할 수 있다.
$$ P = P(V) \neq const $$
$$ W \equiv \int dw = \int^{2}_{1} P(V) \cdot dV $$
식을 보면 알 수 있듯이 적분의 정의에 따라 일 ($ W $)은 P-V curve에서 경로의 밑면적을 의미하게 된다. 아래 P-V curve에서 a, b, c 각 경로의 아래 면적은 각 경로의 일을 의미한다.
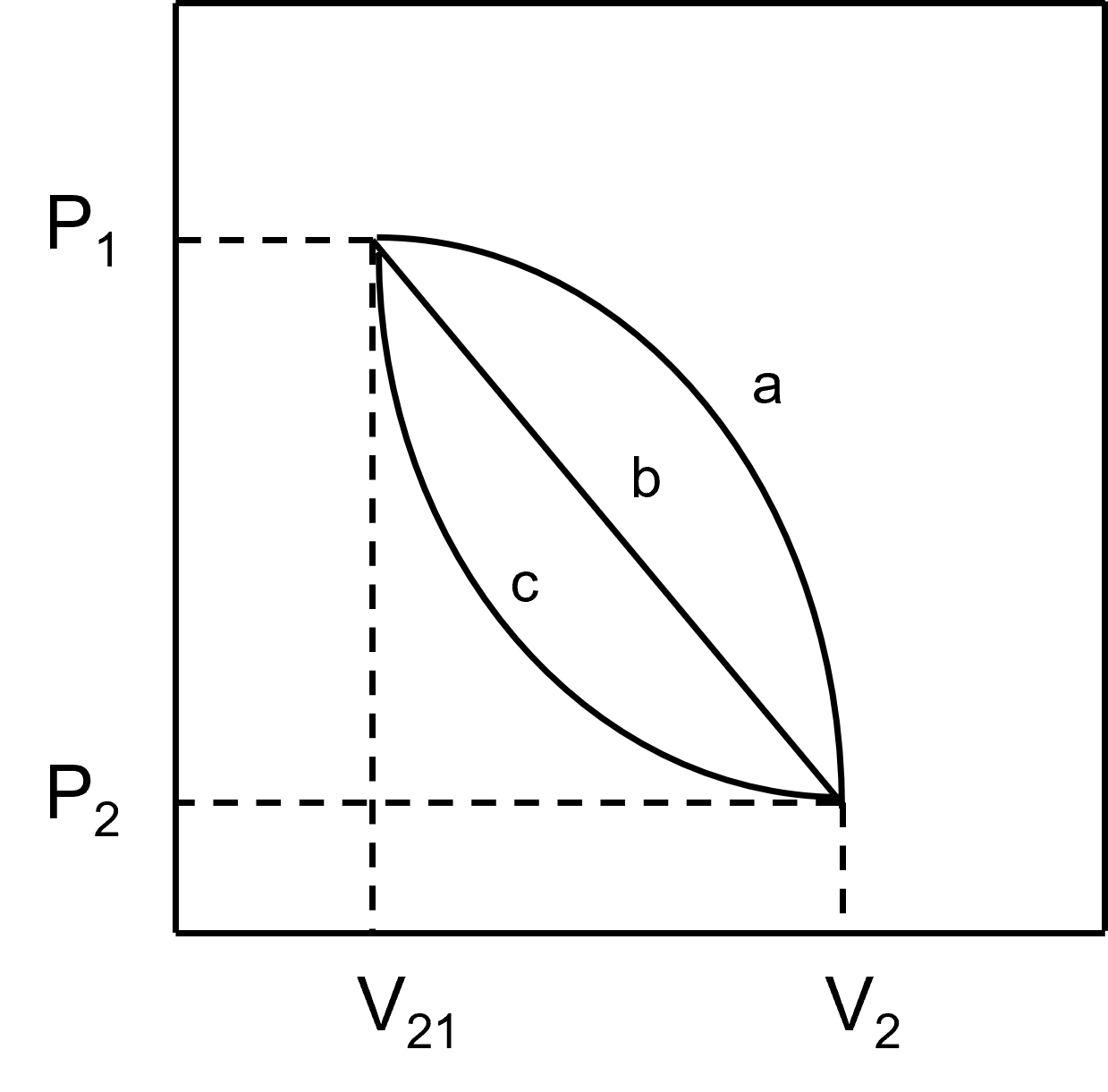
따라서,
$$ W_a > W_b > W_c $$
의 관계를 갖게 된다.
4. 열 (Heat)
열이란, 온도의 차이로 인해 온도가 높은 곳에서 낮은 곳으로 전달되는 에너지의 이동을 말한다. 이때, 부호는
$ q >0 $이면, 흡열(endothermic)을 의미하고,
$ q < 0 $이면, 방열(exothermic)을 의미한다.
5. 열역학 제 1법칙 (The first law of Thermodynamics)
열역학에서 가장 중요한 열역학 제 1법칙에 대해 다뤄보도록 하겠다.
열역학 제 1법칙이란, 에너지 보존법칙과 그 개념이 완전히 같은데, "닫힌계(Closed System)의 내부에너지 변화는 (계에 전달된 열) - (계가 주위에 한 일과 같다)"는 것이다. 식으로 표현하면 다음과 같다.
$$ \Delta U = q- w $$
여기서 $ U $는 내부에너지, $ q $는 열, $ w $는 일을 말한다. 미소변화(Infinitesimal change)는 다음과 같이 표현할 수 있을 것이다.
$$ dU = \delta q - \delta w $$
여기서 d는 상태함수(state variable), $ \delta $는 non-state variable의 미소변화를 의미한다.
예를 들어, 단일성분 계의 내부에너지와 미소변화는 다음과 같이 쓸 수 있다.
$$ U = U(T, V) $$
$$ dU = \left( \frac{\partial U}{\partial V} \right)_T dV + \left( \frac{\partial U}{\partial T} \right)_V dT $$
U는 상태함수이므로, 경로독립적(path-independent)하여 exact differential form을 사용할 수 있다.
그러나, 일과 열은 경로의존적(path-dependent)하므로, 다음과 같이 쓸 수 없다.
$$ \quad q \neq q(T, V) \quad \text{and} \quad w \neq w(T, V) $$
이것은, 상태함수와 경로함수의 중요한 차이점이므로, 반드시 이해하고 넘어가도록 하자.
오늘 포스팅에서는 열역학에서 열과 일의 정의와 열역학 제 1법칙에 대해 알아보았다.
대단히 중요한 개념이니, 꼭 이해해두면 좋겠다.
다음 포스팅부터는 열역학 제 1법칙을 여러가지 과정들(등적, 등온 등)에 적용해보고, 그 의미를 해석해보도록 하겠다.
궁금한 내용이나 질문이 있다면 댓글로 달아주면 친절히 답변해보도록 하고,
그럼 다음 포스팅에서 만나요~!! 안녕~~!!

'전공 공부정리 > 열역학' 카테고리의 다른 글
| [열역학] 1.4 열용량(Heat Capacity) (1) | 2025.06.20 |
|---|---|
| [열역학] 1.3 열역학 제 1법칙 - 등온과정, 단열과정 (0) | 2025.06.20 |
| [열역학] 1.1 기본개념들 - 계와 주위, 상태와 상태량, 경로와 과정, 상태함수와 경로함수 (0) | 2025.03.16 |
| [열역학] 1.5 비균일계(Heterogenous System) 에서의 평형, lever rule (2) | 2024.11.18 |
| [열역학] 1.4 Real Solutions에서의 열역학적 변화 및 분류 (0) | 2024.11.17 |



